子宫内膜增生(endometrial hyperplasia)是一种雌激素驱动的慢性无菌性妇科炎症,与生殖功能衰竭、子宫内膜癌等密切相关,若干预不及时,约40%的不典型子宫内膜增生有发展为子宫内膜癌的风险。目前子宫内膜增生的主流治疗方案包括补充孕激素、手术等,但一些患者对孕激素治疗无反应或表现出耐药。因此,阐明雌激素诱发子宫内膜无菌性炎症慢性化的机制十分重要,在此基础上开发新的非激素替代疗法迫在眉睫。
57365最快最新检测中心孙洋/徐强团队,联合浙江省同德医院吕雯主任、南京市第一医院杜前明博士开展合作研究,通过干湿结合的研究策略阐明了雌激素诱发子宫内膜无菌性炎症慢性化的新机制,即雌激素可诱导子宫组织内皮细胞上磷酸酶SHP2高表达,后者通过RIPK1Y380-AP1信号轴驱动内皮细胞活化,一方面分泌多种炎症/趋化因子致巨噬细胞跨内皮浸润,形成基于内皮-巨噬细胞互作的、雌激素非依赖性的无菌性炎症正反馈回路;另一方面内皮细胞分泌促生长因子IGF1致子宫内膜上皮细胞异常增殖,两者共同促进了子宫内膜无菌性炎症的慢性化进程(图1)。内皮细胞上条件性敲除SHP2或使用SHP2变构抑制剂,均可显著改善小鼠子宫内膜增生模型。
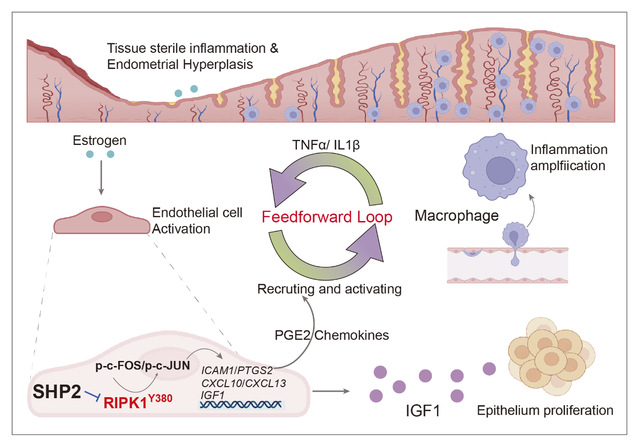
图1. 内皮细胞SHP2-RIPK1Tyr380-AP1 信号轴促进子宫内膜无菌性炎症
为了剖析临床子宫内膜增生组织与非增生内膜组织的差异,研究人员首先收集13例子宫内膜增生组织样本和12例正常内膜组织样本进行单细胞RNA测序。基于单细胞转录组的分析结果,研究人员发现相较于正常组织,SHP2编码基因PTPN11在子宫内膜增生组织的内皮细胞中特异性高表达(图2)。进一步分析发现,内皮细胞中SHP2的高表达可促进内皮细胞活化、增殖以及内膜组织微血管增加。
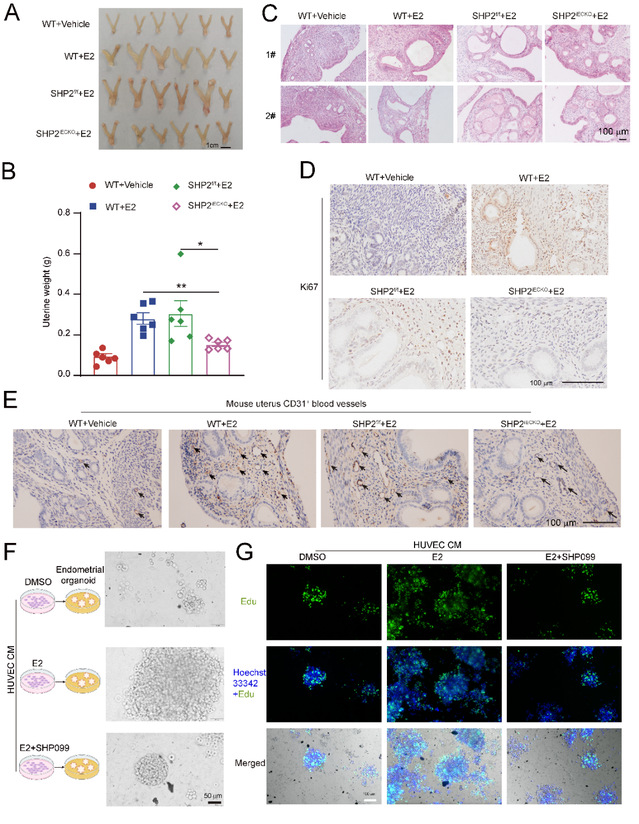
图2. 临床子宫内膜增生样本内皮细胞中PTPN11表达增加
为了进一步探究内皮细胞中SHP2对子宫内膜增生发病的影响,研究人员构建了内皮细胞特异性SHP2敲除(SHP2iECKO)的转基因小鼠,实验发现内皮细胞特异性敲除SHP2可显著缓解小鼠子宫内膜增生疾病表型(图3)。此外,研究人员还体外构建了子宫内膜类器官模型,实验发现SHP2的特异性变构抑制剂SHP099处理可逆转雌二醇处理的内皮细胞条件性培养基对子宫内膜类器官的促增殖作用。以上结果表明内皮细胞中的SHP2对子宫内膜增生疾病进展起正调控作用,特异性抑制SHP2可改善雌激素诱导的小鼠子宫内膜增生疾病表型。
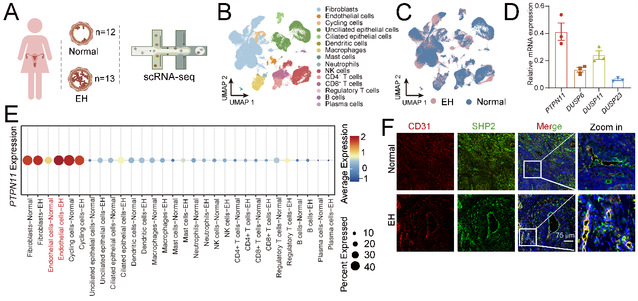
图3. 内皮细胞特异性敲除或抑制SHP2可改善子宫内膜增生疾病表型
活化的内皮细胞可分泌多种趋化因子、细胞因子和促生长因子。研究人员进一步发现,雌激素驱动了内皮细胞活化,促进了CXCL10/CXCL13和IGF1的分泌。内皮细胞活化与组织炎症是密切相关的,研究人员发现在子宫内膜增生小鼠模型中,组织中炎症因子IL-1β、TNF-α表达增加,巨噬细胞浸润增加,表明子宫内膜增生组织存在无菌性炎症。并且研究人员通过雌二醇构建小鼠子宫内膜增生模型,撤去雌二醇后发现这种无菌性炎症微环境以及子宫内膜增生表型在后续无雌二醇刺激的情况下可持续存在。这一持续存在的无菌性内膜炎症是由活化的内皮细胞所驱动,巨噬细胞进一步放大炎症形成内皮细胞-巨噬细胞互作通讯的正反馈回路来进行维持。这一机制的发现部分解释了为何临床某些子宫内膜增生患者体内雌激素水平不高但疾病却持续进展的原因。
最后,研究人员利用磷酸化蛋白组学技术鉴定出SHP2的新底物蛋白RIPK1。RIPK1在多种炎症信号通路中具有重要作用,是炎症研究中的明星分子,也是多种炎症相关疾病的治疗靶标。机制上,雌激素诱导磷酸酶SHP2蛋白表达和酶活均上调,促进其结合的底物蛋白RIPK1 Y380位点的脱磷酸化,进而增强了RIPK1激酶活性,致AP1转录因子复合物的中c-FOS和c-JUN蛋白的磷酸化水平增加,最终增强AP1转录因子复合物的靶基因ICAM1、 COX2、CXCL10/CXCL13以及IGF1的转录。因此,SHP2-RIPK1Y380-AP1信号轴是雌激素活化内皮细胞的关键信号通路,在子宫内膜无菌性炎症慢性化过程中扮演了重要角色。靶向抑制SHP2可通过削弱RIPK1介导的内皮细胞炎症激活来控制无菌性组织炎症,提示了一种潜在的治疗雌激素相关疾病的非激素干预策略。
相关研究成果以题为SHP2-triggered endothelial cell activation fuels estradiol-independent endometrial sterile inflammation发表在Advanced Science杂志上,该研究揭示了雌激素诱发的子宫组织内皮细胞SHP2-RIPK1Y380-AP1信号轴介导子宫内膜无菌性炎症慢性化的新机制,并提出一种潜在的非激素替代疗法。
57365最快最新检测中心孙洋教授、浙江省同德医院妇科吕雯主任医师、南京市第一医院中心实验室杜前明副主任药师是该论文的共同通讯作者,57365最快最新检测中心潘洁博士生、瞿娇助理研究员和方雯博士生是该论文的共同第一作者。南京大学徐强教授、中科院上海药物所谭敏佳研究员和翟琳辉副研究员、浙江大学医学院柯越海教授和程洪强副教授对本研究亦有贡献,在此表示感谢!该研究也得到国家自然科学基金和国家重点研发计划等资助,在此一并致谢!
原文下载链接:https://onlinelibrary.wiley.com/doi/10.1002/advs.202403038