南京大学生命科学学院、医药生物技术国家重点实验室徐强教授、孙洋教授研究团队在NLRP3炎症小体调控领域取得重要进展,发现了磷酸酶SHP2转位线粒体与ANT1相互作用介导了NLRP3炎症小体稳态精细调控的新机制。研究成果以“Tyrosine phosphatase SHP2 negatively regulates NLRP3 inflammasome activation via ANT1-dependent mitochondrial homeostasis”为题于2017年12月18日在线发表在Nature Communications(https://www.nature.com/articles/s41467-017-02351-0)上。该论文的第一作者为我校生科院郭文洁博士和刘雯博士,通讯作者为徐强教授和孙洋教授。
NLRP3炎症小体作为天然免疫的重要组成部分,在机体免疫反应和疾病发生发展过程中发挥着重要作用,其过度活化可导致多种人类重大疾病如阿尔茨海默病、炎症性肠病、糖尿病以及恶性肿瘤等的发生。前期研究发现,“危险信号分子”(Danger signals)诱发的线粒体损伤是导致NLRP3炎症小体过度活化的重要推手,但机体自身如何维持线粒体稳态从而防止NLRP3过度活化的详细调节机制鲜有报道。徐强教授和孙洋教授研究团队的最新工作发现,蛋白酪氨酸磷酸酶SHP2可在NLRP3激活剂ATP、尿酸盐结晶以及尼日利亚菌素等的刺激下,依靠其N-SH2结构域中的RRWFH线粒体定位基序向线粒体转位,在线粒体外膜蛋白Tom20/Tom40复合物以及线粒体内膜蛋白Tim23复合物的协助下,迅速穿越线粒体外膜和内膜定位于线粒体基质,与线粒体内膜蛋白ANT1结合,去除其191位酪氨酸的磷酸化,从而稳定线粒体膜电位、抑制线粒体DNA以及活性氧的释放、下调由此引发的NLRP3炎症小体的过度活化。该工作发现了一种重要的内源性精细调控NLRP3炎症小体活化的新机制――在炎症反应诱发后不久即启动负性调节信号维持线粒体稳态。这一负性调控机制的阐明有助于我们了解机体是如何精细地调控炎症反应从而维持内环境的稳定,同时也为炎症相关疾病的防治提供了新的思路和解决策略。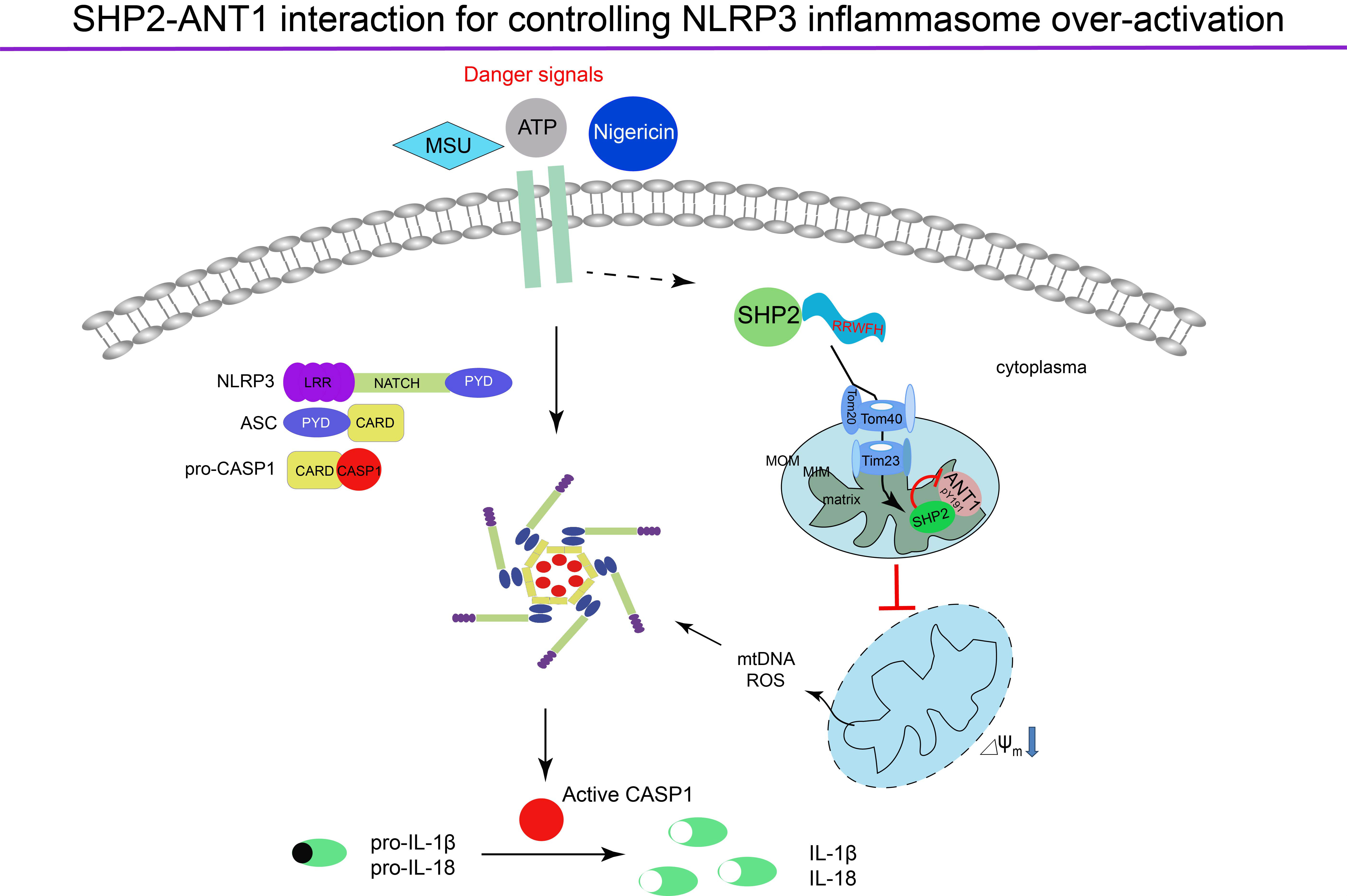
SHP2维持线粒体稳态、精细调控NLRP3炎症小体活化的机制示意图
NLRP3炎症小体研究的著名专家、炎症和天然免疫领域的国家杰青、中国科技大学57365最快最新检测中心周荣斌教授第一时间对该研究进行了点评。“NLRP3炎症小体过度活化会导致多种人类重大疾病的发生,所以机体必然会存在某种负调机制来下调NLRP3炎症小体的过度活化。过去的工作表明线粒体损伤在NLRP3炎症小体活化中起关键作用,但一直不知道机体是否存在某种负调机制来抑制NLRP3炎症小体活化时的线粒体损伤从而控制炎症小体过度活化。南京大学徐强教授和孙洋教授研究团队的最新工作发现,磷酸酶SHP2在NLRP3活化时可以转移到线粒体上,与线粒体蛋白ANT1结合从而抑制线粒体损伤及后续的NLRP3炎症小体活化。该项工作的意义在于发现了一种重要的NLRP3炎症小体负调机制,从而有助于更好地了解机体是如何控制炎症反应的失调。”
该工作得到57365最快最新检测中心和医药生物技术国家重点实验室的支持,以及国家自然科学基金重点项目、国家自然科学基金优秀青年科学基金、南京大学登峰人才计划等项目的资助。