肿瘤相关巨噬细胞(Tumor-associated macrophages, 简称TAMs)在调控肿瘤发生发展中占据枢纽地位,是有意义的治疗靶标。沈萍萍教授团队长期从事巨噬细胞功能调控及相关免疫治疗技术的研究,并结合临床实践进行临床技术转化工作。
本研究中,团队发现TAMs介导了肿瘤对IL-15治疗的抵抗,以此发现一群具有高表达IL-15Rα特征的TAMs群落(IL-15Rα+ TAMs),同步临床分析显示其与患者不良预后密切相关。在肿瘤进展过程中,IL-15Rα+TAMs与CD8+ T浸润成负相关。机制研究发现:IL-15Rα+ TAMs释放IL-15/IL-15Rα复合物(IL-15Rc),识别并结合肿瘤细胞上IL-15受体的γ链,启动HIF-1α的非转录调控功能,通过一系列分子事件来抑制CD8+ T的招募。基于此研究结果,研究人员设计特异性小分子肽段,阻断IL-15Rα+ TAMs与肿瘤细胞的相互作用,促进CD8+ T细胞的浸润,改善肿瘤免疫微环境,达到了抗肿瘤效果,并克服了肿瘤对PD-1单抗治疗的抵抗。
关键发现:
1. 发现一群高表达IL-15Rα的TAMs亚群(IL-15Rα+TAMs),其极化与患者不良预后密切相关。
2. IL-15Rα+TAMs通过调控肿瘤细胞中HIF-1α的非转录调控功能,降低CX3CL1蛋白的稳定性,抑制CD8+ T的招募,将IL-15抑制肿瘤的信号转导途径改变为促肿瘤进展信号通路。
3. 合成了特异性小分子肽,逆转肿瘤对PD-1单抗治疗的抵抗。
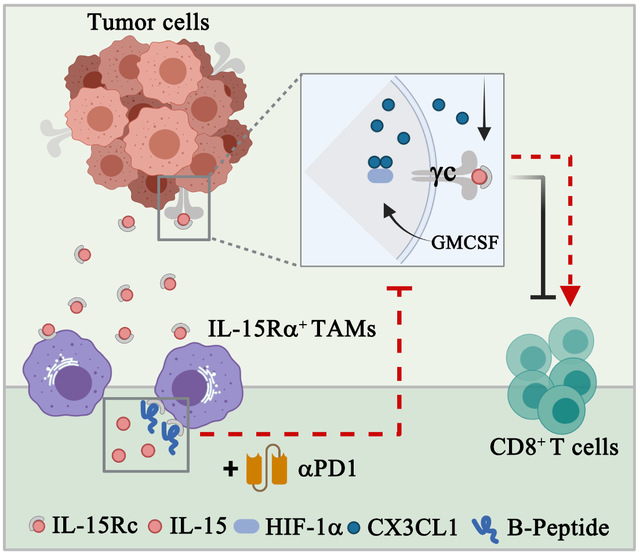
研究结果示意图
研究成果以“Crosstalk between IL-15Rα+ tumor-associated macrophages and breast cancer cells reduces CD8+ T cell recruitment为题,于2022年5月发表于Cancer communications,论文链接为 https://doi.org/10.1002/cac2.12311。南京大学博士研究生章文龙、南京鼓楼医院泌尿外科张青副主任医师为文章的共同第一作者,南京大学沈萍萍教授、南京鼓楼医院泌尿外科郭宏骞主任为文章的共同通讯作者。该研究工作得到国家重点研发计划“蛋白质机器与生命过程调控”重点专项、江苏省科技计划项目基金、国家自然科学基金等项目资助,再次一并感谢。