基因异常表达及突变引起的疾病往往不能够被传统药物所治愈,有效的基因表达干预成为治疗这类疾病的唯一方法。RNA干扰(RNAi)现象被发现之后,该技术迅速被科研人员应用于疾病治疗领域,使基因治疗的发展迎来了巨大的契机。该技术通过导入小干扰RNA(siRNA)特异性抑制致病靶向基因的表达,起到治疗疾病的作用。遗憾的是,虽然RNAi技术让人们看到了基因治疗的曙光,但是siRNA的体内递送问题一直阻碍着RNAi技术的临床应用。如何让siRNA在体内稳定传输,能否找到一种安全、可靠、与机体高度兼容的递送载体,一直是RNAi转化应用的核心科学问题。
南京大学张辰宇团队的前期研究发现,细胞可以包裹小RNA(miRNA和siRNA)到外泌体并将外泌体分泌到细胞外;分泌的小RNA随后会被受体细胞摄取,调节受体细胞中的基因表达。由于外泌体是细胞自身分泌的囊泡,与其他载体相比,其具有低免疫源性和低毒性的特点,是一种良好的小RNA天然载体。因此很多研究人员迅速开始着手尝试利用外泌体递送siRNA。在传统的基于外泌体的siRNA递送策略中,siRNA需要在体外细胞培养环境与外泌体进行预组装,然后通过超速离心等技术从培液上清中分离纯化细胞分泌的、包裹好siRNA的外泌体,从而得到外泌体siRNA并进行体内注射。该方法成本较高,过程复杂不易控制,分离得到的外泌体难以达到临床需求,限制了其大规模实际应用。
2021年3月29日,南京大学张辰宇/陈熹/闫超/李菁团队在Cell Research 发表论文“Invivo self-assembled small RNAs as a new generation of RNAi therapeutics”,建立了新一代的siRNA递送及基因治疗技术,基于体内自组装外泌体siRNA的策略,实现siRNA从表达到装载再到递送的全体内自动化过程。该技术利用合成生物学设计理念,通过向小鼠静脉注射可表达siRNA和外泌体膜表面靶向肽段的合成生物学基因环路(以质粒DNA的形式),将小鼠的肝脏重构成可以产生和分泌siRNA的器官,继而利用机体自身的外泌体体内传输途径,实现siRNA在体内稳定、高效、安全的传输。利用该策略,研究人员成功实现了对肺癌、胶质母细胞瘤和肥胖三种疾病的靶基因干预,达到了显著的治疗效果。

首先,研究人员在体外构建了可以表达siRNA的基因环路,该基因环路可灵活的实现多个siRNA和靶向肽段的插入。通过静脉注射将基因环路导入体内,结果显示,基因环路主要被肝脏摄取。进一步实验显示基因环路可在肝细胞内表达,并指导肝细胞自动生产siRNA及自组装siRNA进入外泌体,自组装的外泌体siRNA进而随血液循环进入肺、肾等多个组织器官。基于此,研究人员在LLC原位移植瘤肺癌模型和KRAS突变的原发肺癌模型中,证实了靶向EGFR和KRAS的siRNA可以被高效递送到肺肿瘤组织并有效降低靶基因的表达,显著抑制了肿瘤的生长并延长了小鼠的生存期。
另一方面,通过在基因环路中插入与外泌体膜表面蛋白相融合的靶向中枢神经系统的肽段(狂犬病毒肽段RVG),可以实现在体内自组装产生靶向中枢神经系统的携带siRNA的外泌体。结果显示通过该复合基因环路体内自组装而成的外泌体siRNA可以高效的穿过血脑屏障,将siRNA递送到中枢神经系统。研究人员通过递送两个靶向胶质母细胞瘤致病基因(EGFR和TNC)的siRNA,显著缓解了颅内胶质瘤的生长,延长了小鼠的生存期。进一步,通过向下丘脑递送靶向PTP1B(该基因敲除小鼠抵抗高脂诱导的肥胖)的siRNA,可同时恢复肥胖小鼠的瘦素敏感性和胰岛素敏感性,增加小鼠的能量代谢,起到缓解肥胖的效果。
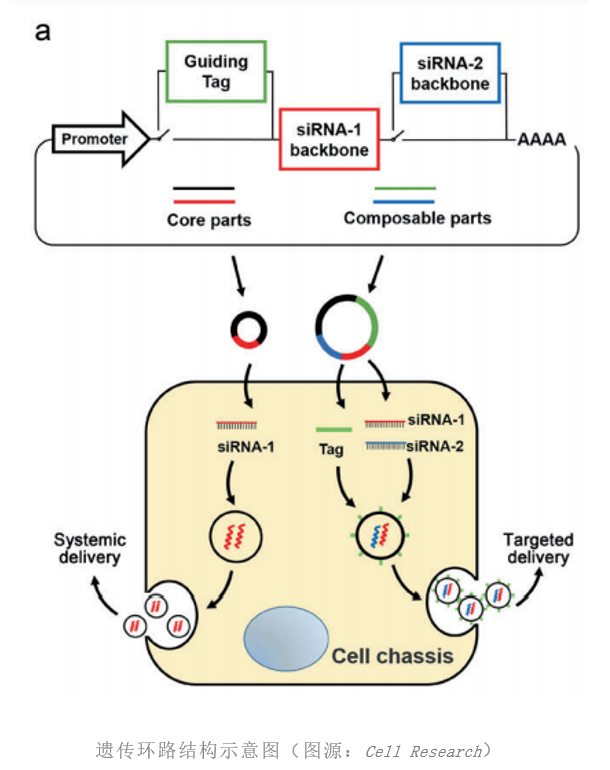
综上,该研究阐述了一种划时代的siRNA递送及基因治疗技术,其优势体现在:(1)利用宿主自己的器官分泌的外泌体为载体,完全解决了siRNA递送载体带来的免疫源性和毒性问题;(2)通过对基因环路的灵活编辑,可同时传输多个siRNA,对疾病进行多靶点打击;(3)特异性的靶向肽段可高效的将siRNA输送到特定的组织,克服血脑屏障等生物屏障的制约。由于该技术使用的合成生物学基因环路的本质是质粒,其设计、生产和应用均非常简单,因此利于该技术的迅速推广和拓展,将极大促进RNAi治疗的发展,具有重大的临床转化价值,有望成为RNAi治疗领域的里程碑,开启基因治疗的新篇章。