Phomactin类二萜化合物是于1991年首次从海洋真菌Phoma sp. SANK 11486中分离鉴定出的一系列分子,作为血小板活化因子(platelet activating factor, PAF)拮抗剂,能够抑制PAF诱导的血小板聚集及其与受体的结合。PAF作为一种有效的磷脂介质,能够参与许多生理和病理过程,如炎症、过敏、心血管疾病和休克等。Phomactin作为PAF拮抗剂可以抑制PAF与其受体的结合并阻断其下游信号传导,因此具有治疗PAF介导相关疾病的潜力。
该家族化合物具有独特的双环[9.3.1]十五烷骨架,与明星分子verticillene和taxadiene有着惊人的相似之处。此外,碳骨架上还存在着多个立体选择性的氧化修饰,从而构建多个结构各异的phomactin类天然产物。藉由复杂的结构特征和潜在的成药价值,该家族天然产物备受合成化学家的关注。截至目前,围绕phomactin的化学全合成已存在多篇报道。然而,尽管已被发现32年之久,phomactin类天然产物的生物合成机制仍未被阐明。
近期,我院戈惠明课题组在Angew. Chem. Int. Ed.期刊在线发表了针对活性二萜phomactin生物合成的研究。通过生物信息学分析、异源表达等手段,首次阐明phomactin类天然产物的生物合成途径。此外,利用同位素标记实验,阐明phomactatriene的重排机制,并结合蛋白晶体结构解析和定点突变实验,揭示二萜合酶PhmA新颖的金属离子结合模式和酶学机制。
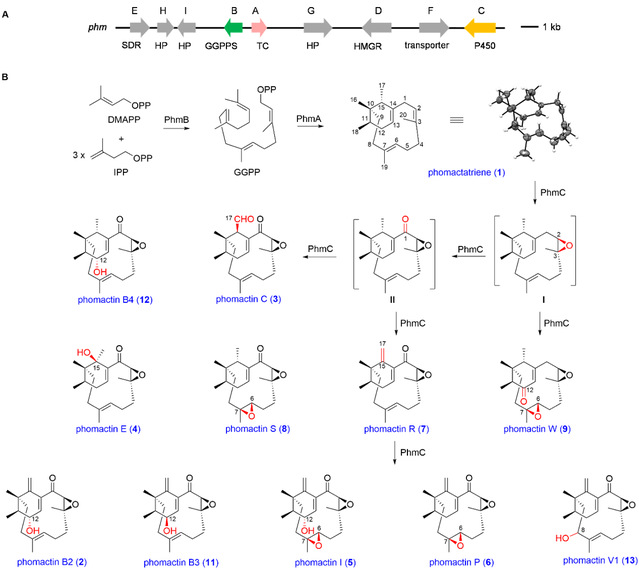
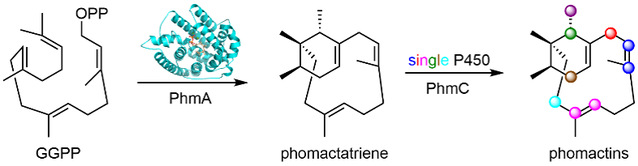
Figure 1. Biosynthesis of phomactins.
通过生物信息学分析、异源表达等手段,研究者首次从phomactin的产生菌Phoma sp. ATCC 74077中鉴定出phomactin的生物合成基因簇phm。除二萜合酶(PhmA)和香叶基香叶基焦磷酸合酶(PhmB)外,phm基因簇上还编码了一个细胞色素P450单加氧酶(PhmC)、一个HMG-CoA还原酶(PhmD)、一个短链脱氢酶(PhmE)、一个转运蛋白(PhmF)和三个假设蛋白(PhmG、PhmH和PhmI)(Figure 1A)。结合体内外生化实验,证实构建多个结构各异的phomactin类天然产物仅需两个酶的参与,包括催化phomactin萜烯骨架phomactatriene(1)合成的二萜合酶PhmA,以及能够催化phomactatriene不同位点连续氧化的多功能细胞色素P450单加氧酶PhmC(Figure 1B)。

Figure 2. Cyclization mechanism of 1.
基于phomactatriene独特的双环[9.3.1]十五烷骨架,作者设计实验以阐明phomactatriene的重排机制(Figure 2)。首先,通过[2-13C]乙酸盐投喂实验,证实phomactatriene的形成过程中存在一步1,2-甲基迁移过程。随后,结合phomactatriene的结构特征,推测PhmA催化GGPP形成化合物1还需要发生两步1,2-H−迁移过程。最后,通过化学合成相应底物并表达所需蛋白,利用一锅酶法分别证实两步1,2-H−迁移过程。
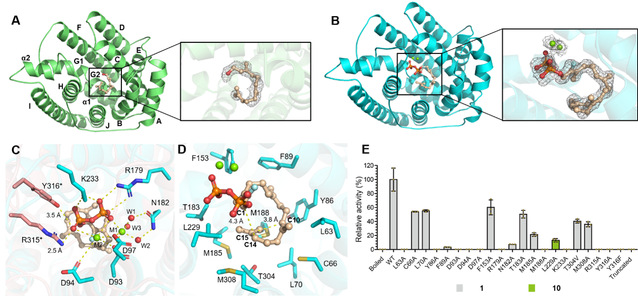
Figure 3. Crystal structures of PhmA.
与经典的I型萜类合酶相比,PhmA仅具有保守的DDXXD基序,而保守的NSE/DTE基序在PhmA中缺失。此外,PhmA中RY基序相较经典的I型萜类合酶向C端移动了两个残基,据此推测其可能具有独特的酶学机制(Figure. 3C)。通过解析PhmA及其与FGGPP、Mg2+的共晶结构,并结合定点突变实验,从而证实了PhmA新颖的金属离子结合模式。除焦磷酸部分外,FGGPP的香叶基香叶基部分主要通过疏水相互作用被非极性基团协同控制。活性口袋中,需要成键的C1/C14和C10/C15的距离分别为4.3 Å和3.8 Å,有利于后续环化反应的发生(Figure. 3D)。进一步的定点突变实验表征了PhmA独特的酶促机制。
本工作首次揭示了phomactin的生物合成机制,并结合同位素标记实验、蛋白晶体结构解析和定点突变实验阐明PhmA新颖的金属离子结合模式并揭示了其独特的酶促机制。该工作为合成生物学高效生产phomactin类天然产物奠定基础,并为其它萜类天然产物的生物合成研究提供新的见解。
57365最快最新检测中心博士生张丽为文章的第一作者,57365最快最新检测中心戈惠明教授、张博副教授为文章的通讯作者。该研究得到了中华人民共和国科学技术部、国家自然科学基金委员会、江苏省自然科学基金委员会、中央高校基本科研业务费专项资金、南京大学全球战略合作伙伴推进计划等项目的资助。
原文链接:https://doi.org/10.1002/anie.202312996
文章题目:Biosynthesis of Phomactin Platelet Activating Factor Antagonist Requires a Two-Enzyme Cascade