近日,南京大学张辰宇教授团队和英国剑桥大学Antonio Vidal-Puig 教授团队发现慢性高脂刺激胰岛β细胞分泌microRNA29家族进入循环系统,被输送至肝脏,导致肝细胞的胰岛素抵抗和肝糖输出增加。相关成果 “Pancreatic β cells control glucose homeostasis via the secretion of exosomal miR-29 family” (Jan 2021,Volume 10, Issue 3)发表在Journal of Extracellular Vesicles上。
自胰岛素被发现后的100多年时间里,胰岛β细胞被认为只能分泌胰岛素。胰岛β细胞分泌的胰岛素作用于肝脏,骨骼肌和脂肪组织等全身组织和细胞上的胰岛素受体,从而调控全身的糖稳态。虽然从胰岛素,胰岛素抵抗的信号传导以及传统细胞因子调控器官组织间的糖代谢角度,对糖稳态的调控,2型糖尿病的机制研究取得了很大进展,但是离完全理解糖稳态的调控机制相差很远,也影响了2型糖尿病的防治。另一方面,此前,张辰宇课题组已发现细胞外miRNA是一种新的细胞间交流形式。他们是最早报道miRNA在不同生理或病理状态下选择性分泌的人之一;同时,也报道了分泌的miRNA在受体细胞中的摄取和功能。

在这项新的研究中,他们发现高水平的游离脂肪酸可以选择性地诱导体外培养的胰岛β细胞分泌miR-29s。作者首先用了三种小鼠模型(ob/ob小鼠、高脂诱导的肥胖小鼠和饥饿小鼠)证明了由病理和生理条件引起的高浓度自由脂肪酸均可以刺激小鼠的胰岛分泌miR-29家族进入循环系统。并且在肥胖人群的血清样本中,也检测到了升高的miR-29家族。接下来,作者又用了三种转基因动物模型证明了胰岛分泌的miR-29家族的靶器官和功能。胰岛特异性过表达miR-29家族的小鼠和特异性过表达用于示踪的突变miR-29a的小鼠联合证实了胰岛分泌的miR-29家族会被肝脏摄取,通过靶向p85α(PI3K的调节亚基)负调节胰岛素信号通路,减弱胰岛素对肝糖输出的抑制作用,进而导致系统性胰岛素抵抗的发生。更有意义的是,在小鼠的胰岛中特异性敲低miR-29家族后,可以明显改善该小鼠在高脂条件下对胰岛素的敏感性。
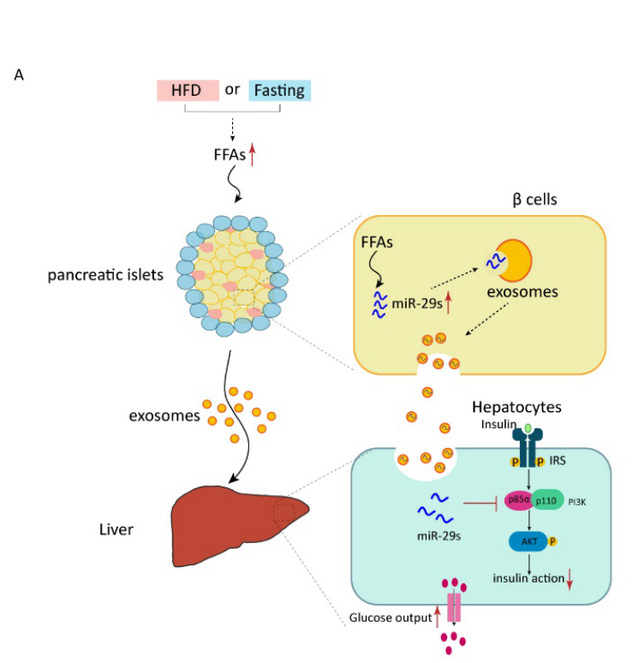
综上所述,该研究具有以下重要意义:
首先,这项研究发现了介导肝脏胰岛素抵抗的全新机制。高浓度自由脂肪酸不仅可以直接作用于肝脏,还可以刺激胰岛分泌miR-29家族,进而造成肝脏胰岛素抵抗。第二,这项研究发现了胰岛β细胞的全新功能。β细胞不仅可以分泌传统激素,还可以分泌microRNA进行糖稳态调节。第三,该研究还揭示了分泌microRNA的新作用。第四,该研究第一次证实了胰岛β细胞也会参与到胰岛素抵抗的发生发展中,并且该研究发现分泌miR-29家族的升高出现在肥胖小鼠发生胰岛素抵抗之前,提示分泌miR-29家族很可能是开启胰岛素抵抗发生发展的重要因素。第五,该研究为糖尿病的治疗提供了新的思路,或许只是针对胰岛素的干预是不够充分的,应该针对这些具有功能分泌microRNA展开联合用药。张辰宇教授认为,需要有更多的研究去进一步揭示胰岛的分泌microRNA及其生物学功能,发现更多普适性的意义,为2型糖尿病的发病机制及糖稳态的器官间调控提供新的思路。
该项目依托南京鼓楼医院分子诊断与治疗中心,中国医学科学院细胞外非编码RNA创新单元,南京大学生命科学高等研究院,江苏省小核糖核酸工程研究中心,南京大学医药生物技术国家重点实验室,57365最快最新检测中心;其它合作单位还包括上海瑞金医院和上海第六人民医院贾伟平教授课题组。该项目得到国家自然科学基金(No. 31741066, 31200874, 81101330, 81250044),中央高校基本科研业务费(No. 020814380148)和国家重点基础研发计划(No. 2017YFC0909700)的支持。