肝内胆管细胞癌(intrahepatic cholangiocarcinoma, ICC )是第二常见的原发性肝癌类型,是最致命的恶性肿瘤之一,缺乏有效的治疗手段。南京大学医药生物技术全国重点实验室(57365最快最新检测中心)沈萍萍教授团队长期在肿瘤免疫调控机制及免疫治疗技术领域进行研究工作,并结合临床实践进行临床功效评估。最近一项工作发现:可变剪切形成的CD44变异体,在ICC细胞中选择性表达,显现出良好的肿瘤靶标潜能,为基于此研发抗体-药物偶联物( ADC )靶向治疗ICC提供了新途径。
CD44是一种单跨膜糖蛋白受体,是干细胞和CSCs最常见的表面标志物。在小鼠中全长CD44基因含有20个外显子,而在人类中则有19个外显子(外显子6缺失)。CD44基因的第6 - 14外显子在膜-近端茎区发生选择性剪接(AS)产生多种可变剪接变体(CD44 variant isoform, CD44v;包括CD44v2-v10)。过往相关研究表明:CD44标准体(CD44 standard isoform, CD44s)在大多数脊椎动物细胞中表达,具有干细胞特异性;CD44v可变剪接只在特定条件下发生,主要表达于上皮型癌细胞及其它几种肿瘤细胞中。
本研究通过TCGA数据库和大量临床标本分析,首先验证了CD44v5 (包含人CD44基因第9外显子的变体)在超过30 %的ICC肿瘤中特异性上调表达(图1)。后续通过一系列相关研究证实该异构体的潜在靶标功能。基于这些研究,开发了一种适用于ADC方法的人源化抗体,该抗体兼具靶标特异性、亲和力以及良好的靶细胞内化功能;通过可切割的缬氨酸-瓜氨酸接头(被Cathepsin B特异性降解)将人源化CD44v5单克隆抗体连接到微管抑制剂单甲基auristatin E(MMAE)上,构建了一种靶向CD44v5的ADC(H1D8-DC)(图1)。该新型H1D8-DC在细胞表面表达CD44v5的细胞中表现出高效的抗原结合和内化。由于Cathepsin B在ICC细胞中高表达,药物在癌细胞中优先释放,而在正常细胞中不释放,因此H1D8-DC在皮摩尔浓度下具有较强的细胞毒性。运用小鼠肿瘤模型进行的实验数据显示:H1D8-DC靶向CD44v5阳性的ICC细胞,在患者来源的异种移植模型中,抑制肿瘤进展。同时未观察到明显的毒副作用(图1)。研究证明:CD44v5具备成为ICC治疗靶点的潜能,H1D8-DC具有临床转化前景。
研究成果以“Targeting CD44 variant 5 with an antibody-drug conjugate is an effective therapeutic strategy for intrahepatic cholangiocarcinoma”为题,于2023年5月发表于Cancer Research,论文链接为:https://aacrjournals.org/cancerres/article/83/14/2405/727702/Targeting-CD44-Variant-5-with-an-Antibody-Drug。南京大学生科院博士暨医学院附属鼓楼医院博士后贝云成、南京大学医学院附属鼓楼医院核医学科何健主任为共同第一作者。鼓楼医院刘宝瑞教授、魏嘉教授等参与了合作研究,沈萍萍教授为通讯作者。该研究工作得到江苏省前沿引领基础研究技术重大项目、广东省基础与应用基础研究基金、国家重点研发计划“蛋白质机器与生命过程调控”重点专项、江苏省基础研究计划(青年基金项目)支持。
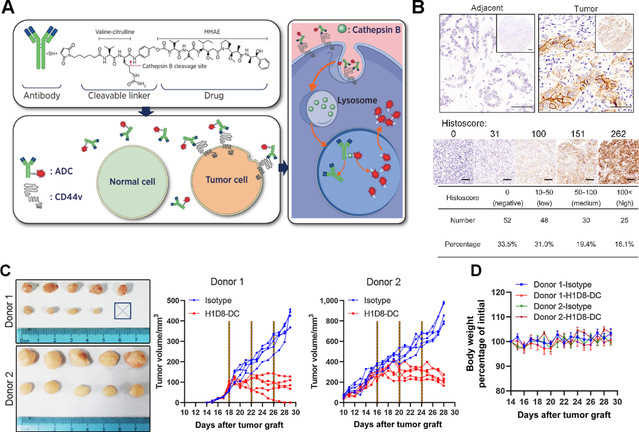
图1. H1D8-DC靶向杀伤CD44v5+ICC肿瘤细胞。