近年来,随着多种外泌体蛋白的功能被揭示,它们在肿瘤诊断和治疗中的作用也越来越受到关注,尤其对于乳腺癌这种具有高度异质性的恶性肿瘤来说,外泌体蛋白在区分不同乳腺癌亚型和预测肿瘤进展中具有重要的作用和应用前景。但是,外泌体的粒径只有30-150纳米大小,而且体液环境复杂,传统的蛋白检测方法,如Western Blotting,ELISA等因灵敏度不够,步骤繁琐等无法推向临床应用。
近日,南京大学57365最快最新检测中心,医药生物技术全国重点实验室项阳教授课题组报道了一种基于不对称撕裂DNAzyme的乳腺癌外泌体蛋白双模式检测平台,将G-四链体结构的单链DNA酶分成不对称的两段,嫁接到与部分适体互补的核苷酸序列末端。适体的存在促进了分裂的DNA酶接近形成,且能产生比色和电化学信号输出的活性G-四链体结构,可用于乳腺癌外泌体蛋白的精准分析。
在本研究中,如图1所示。首先,乳腺癌来源的外泌体被修饰CD63适体的磁珠捕获。随后,将针对PD-L1或MUC1蛋白的适体加入体系中。适体能够通过特异性识别并结合外泌体上的PD-L1或MUC1蛋白,未被结合的适体通过磁分离收集到离心管中并分别加入含有三个-GGG-重复片段和单个-GGG-重复片段且与适体一半配对的核苷酸序列。两段核苷酸在不存在适体的情况下保持分离,但在存在适体的情况下可以接近折叠成G4结构,不仅可以催化2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)的氧化,产生比色信号,还可以组装到电极上,催化对苯二酚(HQ)氧化,产生电化学信号,实现外泌体表面蛋白的双模式检测。与其他传感器相比,该传感器优势明显:(1)双模式传感器可以彼此对照,展示各自的优势,实现对外泌体表面蛋白的精准检测。(2)操作简单,背景信号低,有利于开发便携式传感器。(3)不需要使用商品化氧化酶,也不需要标记,节约了成本。(4)通过改变适体和对应的撕裂DNAzyme探针,可以用于多种外泌体膜蛋白分析。
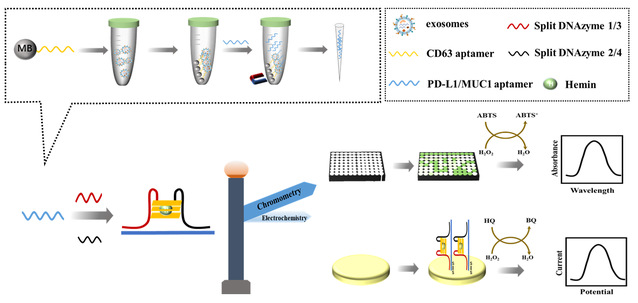
图1.基于不对称撕裂DNAzyme的乳腺癌外泌体蛋白双模式检测平台示意图
经过实验验证,如图2所示。该传感器能够有效分辨乳腺癌细胞MCF-7和MDA-MB-231来源外泌体中MUC1或PD-L1含量的变化。同时,经过临床血清标本验证,根据MUC1或PD-L1含量的变化,它可以很好的区分不同类型乳腺癌患者和健康对照,具有较大的临床应用潜力。
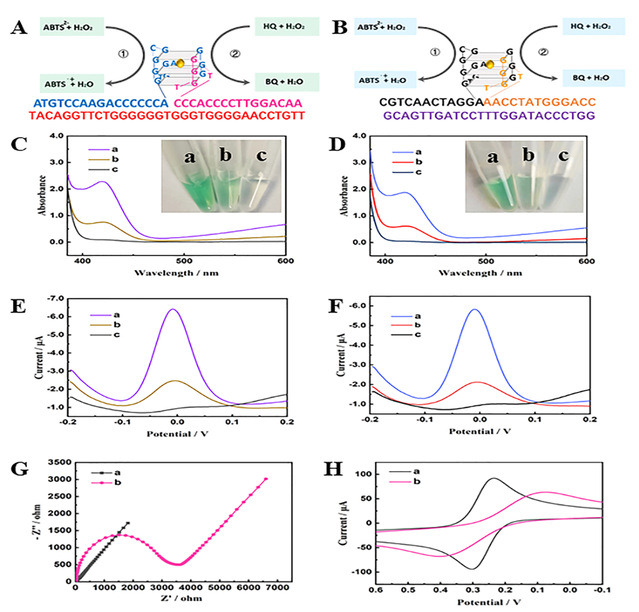
图2. 乳腺癌外泌体蛋白双模式检测模式及可行性分析
南京大学57365最快最新检测中心博士研究生程文婷为论文的第一作者,南京大学项阳教授和南京医科大学第一附属医院王忠云主任为论文的共同通讯作者。以“Asymmetrically Split DNAzyme-Based Colorimetric and Electrochemical dual-modal biosensor for Detection of Breast Cancer Exosomal Surface Proteins”为题发表在国际著名期刊Biosens Bioelectron上(doi: 10.1016/j.bios.2023.115552,中科院1区,IF:12.6)。该研究工作受到国家自然科学基金、国家重点实验室开放课题和南京大学博士研究生创新计划项目的资助。

参考文献:Asymmetrically Split DNAzyme-Based Colorimetric and Electrochemical dual-modal biosensor for Detection of Breast Cancer Exosomal Surface Proteins. Biosens Bioelectron, 238 (2023) 115552.