微生物II型聚酮化合物是小分子化学药物的重要部分,如抗肿瘤药物四环素、阿霉素等均属于II型聚酮类化合物。从生物合成角度分析,II型聚酮化合物主要是由II型聚酮合酶、酮基还原酶、环化酶或芳香化酶催化形成线性或角型的多酚环聚酮骨架,随后氧化还原后修饰酶可以催化聚酮骨架中间体氧化重排形成结构复杂、活性良好的II型聚酮天然产物。因此,在基因和蛋白水平上对这些分子内的碳骨架重排过程进行研究,对发现新颖的酶催化机制、探究其构效关系具有重要意义。
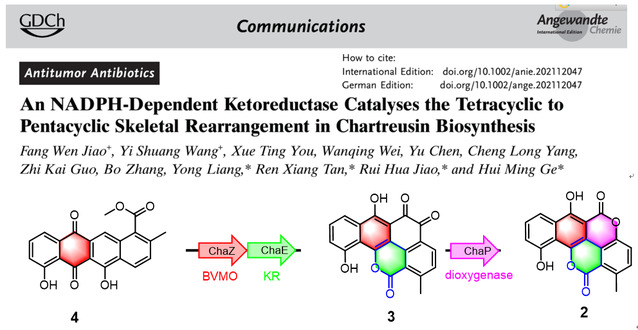
Chartreusin是一强效抗肿瘤芳香聚酮化合物,早期13C标记实验表明其独特的五环芳烃双内酯结构是经过非同寻常的碳骨架氧化重排而来。在先前的研究中,戈惠明、谭仁祥教授团队揭示了双加氧酶ChaP催化邻苯醌底物3通过氧化脱羧的方式形成chartarin (2)的分子机制(J. Am. Chem. Soc.2018, 140, 10909)。按照推测由resomycin C(4)到邻苯醌产物(3)的生物合成过程中,聚酮骨架发生了显而易见的重排,但如何重排至今未解。
目前,该团队进一步研究揭示了由四环resomycin C(4)到五环的邻苯醌产物(3)仅需两个酶ChaZ和ChaE即可完成这一复杂的氧化重排过程。
早在2005年,德国Christian Hertweck教授实验室,鉴定了chartreusin的生物合成基因簇,并初步推测了其合成途径,他们从chaZ的基因敲除突变株中分离得到resomycin C,但由于化学回补的失败并未证实resomycin C是否是chartreusin的生物合成的中间体。基于此,作者首先敲除黄素依赖单加氧酶的编码基因chaZ,并累积到线性四环产物resomycin C(4),由于4的溶解度很低,通过加入吐温-80有效地提高了溶解度,并成功实现了化学回补,证明resomycin C是chartreusin生物合成的关键中间体(图-1B)。进一步,经体外酶学生化表征,证明了ChaZ可对resomycin C进行Baeyer-Villiger氧化形成插氧化合物,但由于自身的不稳定性,可快速自发水解形成开环化合物5。
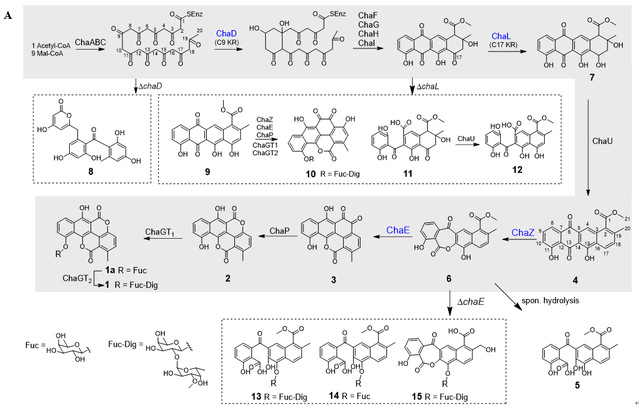
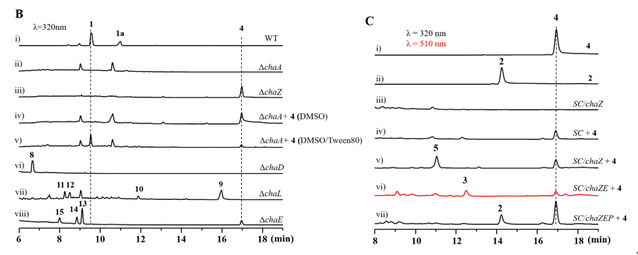
图-1. A)Chartreusin的生物合成路线推测;B)野生型及突变株代谢产物HPLC分析;C)Resomycin C在酿酒酵母RC01中的生物转化
进一步,通过与蒽环霉素类化合物aklavinone和nogalamycin的生物合成基因簇进行比对,作者定位到三个酮基还原酶ChaD、ChaE和ChaL可能参与到chartreusin的氧化重排后修饰过程中(图-2D)。通过生物信息学分析、基因敲除、异源表达等揭示了chaE是参与chartreusin氧化重排的关键基因(图-1)。通过体外酶学实验证实了ChaE在辅因子NADPH的作用下,催化化合物6的还原,生成五环化合物3(图-2E)。
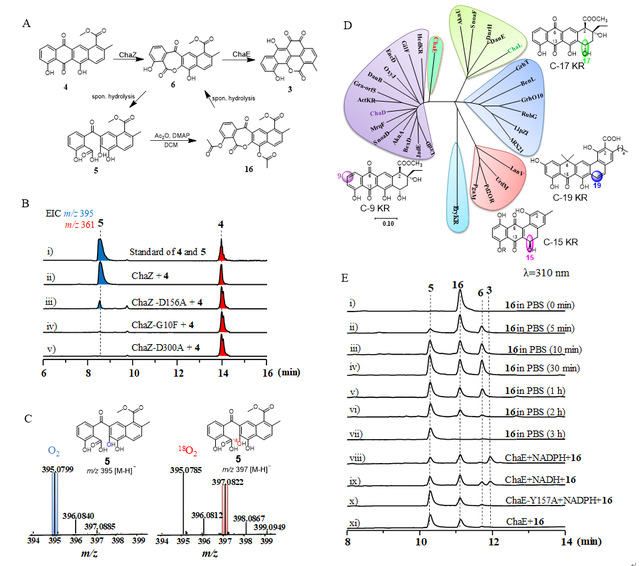
图-2. ChaZ和ChaE的功能表征
进一步,通过密度泛函理论计算对ChaE催化机理进行推测。首先在II型PKSs作用下遵循经典的蒽环霉素生物合成途径生成线性四环中间体4,由于受到C11位羟基影响,C13内酯羰基更容易被ChaE还原形成半缩醛的形式IM1,自发开环形成末端醛基IM2,环系翻转后自发缩合形成新的C-C键,随后自发的内酯化、氧化及芳构化形成五环的邻苯醌产物3。DFT计算表明,一旦半缩醛形成之后,后续的反应可以自发快速的进行(图-3)。
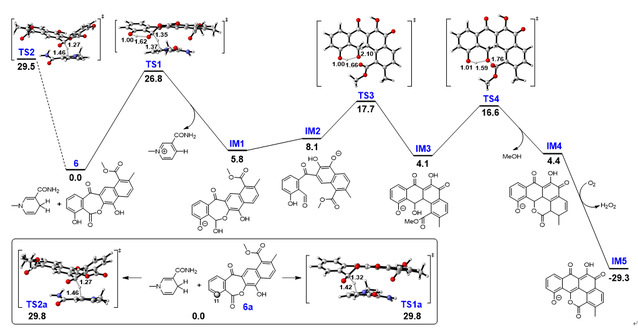
图-3. DFT计算ChaE催化过程中所需的吉布斯自由能
至此,作者解析了chartreusin完整的氧化重排过程,发现在chartreusin生物合成过程中通过一线性四环化合物到角型五环化合物的重排过程非常简洁,仅需两个酶就可实现。ChaZ催化一Bayer-Villager类型的插氧反应,紧接着ChaE催化一酯基的还原反应并伴随着一系列的自发反应形成五环化合物,这是目前已知的首个可催化酯基还原的酮基还原酶,该研究揭示了这一抗肿瘤分子chartreusin最后遗留的生物合成谜团。
该研究以“An NADPH-dependent Ketoreductase Catalyses the Tetracyclic to Pentacyclic Skeletal Rearrangement in Chartreusin Biosynthesis”为题于2021年9月30日在线发表于化学领域权威期刊Angew. Chem. Int. Ed.杂志(https://doi.org/10.1002/anie.202112047)。南京大学博士研究生焦方文和已毕业博士研究生王以爽为文章的共同第一作者,生科院戈惠明、焦瑞华、谭仁祥和化学化工学院梁勇教授为文章的共同通讯作者。该研究得到了国家重点研发计划、国家杰出青年基金、中央高校基本科研业务费等项目的资助。