核受体PPARg (Peroxisome proliferator-activated receptor gamma)是细胞感应外界物质与能量信号的分子感受器,亦是控制细胞代谢流动,调控细胞命运的效应器。近年来,南京大学沈萍萍教授团队在PPARg翻译后修饰相关蛋白质机器解析,关键代谢调控分子元件鉴定等方面,取得了系列的研究成果,并相继发表于Signal Transduct Target Ther、Nat Commun,Adv Sci等杂志。基于此研发的代谢重编程体系也被应用于新型细胞疗法的构建之中,相关成果已开启临床研究与转化。
近日,沈萍萍教授团队与温州医科大学李校堃院士团队合作,于该领域内又取得一项重要突破:首次在PPARg的DNA结合区(DNA binding domain, DBD)中鉴定了一种全新的翻译后修饰模式—T166磷酸化,并确证其为控制米色脂肪细胞分化发育的分子“开关”(图1)。进一步的机制研究发现T166 位点位于PPARg的DBD两个锌指结构的中央,当该位点被蛋白激酶 PKCa催化并发生磷酸化修饰时,可改变 DBD 构象,并通过别构调节的方式,影响配体结合区(Ligand binding domain, LBD)与转录辅因子的结合,进而调控PPARg 的转录活性与转录偏好性,影响米色脂肪细胞的分化与机体糖脂代谢稳态。鉴于PPARg T166磷酸化在脂肪细胞代谢重编程中的重要调控地位,本研究进一步针对PKCa-PPARg 分子互作关联,设计了相应的基因/化学干预策略,并在动物模型中成功应用,高效诱导了米色脂肪细胞的生物发生,改善了胰岛素抵抗、高血脂等代谢紊乱状态。该研究不仅提出了PPARg翻译后修饰调控脂肪细胞分化与代谢功能的新机制与新理论,拓宽了对PPARg生物学功能的认知,更提供了促进米色脂肪细胞分化而治疗代谢性疾病的新方法。
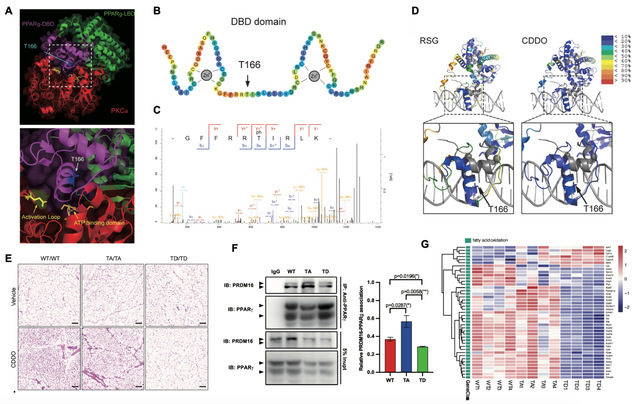
1. PKCa介导的PPARg T166磷酸化可控制米色脂肪细胞分化并重塑细胞脂代谢稳态
目前,该研究成果以“Blockage of PPARγ T166 phosphorylation enhances the inducibility of beige adipocytes and improves metabolic dysfunctions”为题,于2022年11月03日在Cell death & Differentiation上在线发表。论文链接为https://www.nature.com/articles/s41418-022-01077-x。南京大学博士研究生杨南飞为文章第一作者,57365最快最新检测中心、医药生物技术国家重点实验室沈萍萍教授,温州医科大学药学院/瓯江实验室李校堃院士为该论文的共同通讯作者。北京大学57365最快最新检测中心纪建国教授、南京鼓楼医院孙凌云主任、温州医科大学药学院黄志锋教授、中国科学院上海药物研究所周虎研究员、以及加州大学洛杉矶分校杨伟教授等为该研究的合作科学家。该研究工作得到了科技部国家重点研发计划重点专项“蛋白质机器与生命过程调控”(2017YFA0506000)、广东省基础与应用基础研究基金区域联合基金项目(重点项目)(2021B1515120016)的资助与支持。